Archiv der Kategorie: Allgemein
Nachlese 123. Fortbildungsseminar – periop. Schmerztherapie
Nachlese 123. Fortbildungsseminar – periop. Flüssigkeitstherapie
Flüssigkeitstherapie: Volumen & Bilanzierung
Doz. Dr. Martin Dünser
Klinik für Anästhesie und Intensivmedizin, Universitätsklinik Salzburg und PMU
1. Wann muss ich Volumen geben?
Die Indikation zur Gabe von Volumen ist das Vorhandensein einer systemischen Minderdurchblutung, welche durch einen Volumenmangel bedingt ist. Eine systemische Minderdurchblutung kann am besten klinisch diagnostiziert werden. Wichtig ist, dass der Blutdruck ein sehr schlechtes Maß für die Gewebedurchblutung darstellt. Viele Patienten sind minderdurchblutet, obwohl sie (noch) einen normalen Blutdruck aufweisen. Daher hat es sich klinisch bewährt, eine systemische Minderdurchblutung als das Vorhandensein von zwei oder mehr der folgenden Zeichen zu definieren:
• Hautmarmorierung oder schlechte periphere Perfusion (z.B. kalte Hände/Füsse)
• Kaltschweißigkeit
• Oligurie
• erhöhtes Laktat (>2 mmol/L oder >18 mg/dL)
• erniedrigte zentral-/gemischtvenöse SO2 (<60%)
• Verwirrtheit/Unruhe
Ist ein Patient adäquat durchblutet (d.h. ist nur eines oder keines der oben genannten klinischen Zeichen vorhanden) besteht KEINE Indikation zu einer Volumentherapie. Häufig verwendete Trigger für eine Volumentherapie (z.B. tiefer ZVD, Anstieg des Blutdrucks auf Volumengabe, „Swing“ in der Arterienkurve, sonstige Zahlen und Meßwerte) stellen alle keine Indikationen für eine Volumengabe dar solange eine adäquate systemische Gewebedurchblutung besteht.
2. Wem darf ich trotzdem kein Volumen geben?
Patienten, welche eine eingeschränkte Herzfunktion aufweisen, sollten kein weiteres Volumen erhalten, welches sie nicht ins arterielle System pumpen können (=fehlende Volumenreagibilität). Die Flüssigkeitsgabe erhöht bei Patienten mit fehlender Volumenreagibilität lediglich die kardialen Füllungsdrücke und verursacht Organdysfunktionen (bei Rechtsherzversagen: Leber-/Nierenstauung/-dysfunktion; bei Linksherzversagen: Lungenödem/-stauung). Daher ist es entscheidend, Volumen nur Patienten zu verabreichen, bei denen eine Volumenreagibilität besteht. Die Abschätzung der Volumenreagibilität ist auch mit unterschiedlichen Methoden nicht sicher möglich. Die Klinik (Halsvenenstauung, obstruktive Atmung bei Lungenstauung) ist nur im Extremfall (Lungenödem) aufschlussreich. Andere Methoden (Herzultraschall, Atemschwankungen der Vena cava inferior im Ultraschall u.v.m.) sind zwar sensitiver und spezifischer bei der Vorhersage der Volumenreagibilität, letztlich aber auch nie 100% sicher. Die einzige definitive Methode zur Abschätzung der Volumenreagibilität ist der Volumentest. Dabei wird (eine kleine Menge) Flüssigkeit 2
unter kontrollierten Bedingungen und engmaschiger Überwachung verabreicht und getestet, ob eine Volumengabe zu einer Verbesserung der Kreislaufsituation und insbesondere der Gewebedurchblutung führt (siehe Punkt 4).
3. Wie und was gebe ich?
Hypovolämie und Hypervolämie schaden, insbesondere im perioperativen Setting (Cave: Hypervolämie und pulmonale bzw. gastrointestinale Komplikationen sowie perioperative Mortalität!). Daher ist das Erzielen einer Normovolämie entscheidend. Dieser Zustand ist jedoch häufig eine Gratwanderung und dynamisch (d.h. bei vielen Zustandsbildern wie z.B. der Sepsis, Pankreatitis, etc. kommt es zumeist durch ein Kapillarleck zu einem anhaltenden Volumenbedarf, d.h. die Hypovolämie tritt immer wieder erneut auf auch wenn sie wenige Stunden zuvor bereits ausgeglichen wurde). Entscheidend hierbei sind das rasche Erkennen einer Hypovolämie-bedingten Minderdurchblutung (siehe oben) und die rasche Volumengabe. Um eine Hypervolämie zu vermeiden hat sich die Verabreichung von Flüssigkeit in kleinen Portionen (50 mL z.B. mit Perfusorspritze oder 250 ml-weise) bewährt. Wichtig ist nach jeder Volumengabe zu überprüfen, ob 1) noch eine Gewebeminderdurchblutung besteht bzw. (sollte eine solche fortbestehen) 2) der Patient von der Volumengabe profitiert hat.
Die Art der Flüssigkeit ist in den meisten Fällen wahrscheinlich weniger entscheidend als die rasche und nachhaltige Herstellung einer adäquaten Gewebedurchblutung. Grundsätzlich gilt, dass synthetische Kolloide (insbesondere Hydroxethylstärke, z.B. Voluven®) verglichen mit Kristalloiden zu einer Verschlechterung der Organfunktionen (Niere, Gerinnung) und Mortalität bei kritisch kranken Patienten führt. Daher sollten diese vermieden werden. Albumin kann verwendet werden, ist aber teuer. Bei Patienten mit Schädelhirntrauma ist es kontraindiziert; bei Patienten mit Sepsis evtl. vorteilhaft. Unter den Kristalloiden könnten Chlorid-arme Infusionslösungen (sog. balancierte Lösungen wie Ringer-Laktat, Elomel isoton) der isotonen Kochsalzlösung (NaCl 0,9%) überlegen sein. Dies spielt allerdings bei moderaten Volumenumsätzen (Plusbilanzen bis 3-4 L) keine klinisch relevante Rolle.
4. Wie überprüfe ich, ob mein Volumen was nützt?
Führt eine Volumengabe zu einer positiven Antwort soll weiter Volumen verabreicht werden. Eine positive Antwort kann durch rasche Parameter innerhalb weniger Sekunden bzw. Minuten nach Volumengabe erkannt werden. Solche raschen Indikatoren sind zum Beispiel ein Anstieg des Blutdruckes, des Herzzeitvolumens oder der zentralvenösen Sättigung bzw. ein Abfall der Herzfrequenz. Zeichen für eine ausbleibende Antwort bzw. sogar nachteilige Effekte sind fehlende Veränderungen in oben genannten Parametern gepaart mit einem Anstieg der Füllungsdrucke (z.B. zentraler Venendruck) oder Verschlechterung der Klinik (z.B. Lungenödem). Langsame Parameter (z.B. Verbesserung der peripheren Perfusion, rückläufige Hautmarmorierung, sinkendes Laktat, ansteigende Harnausscheidung) benötigen 20-60 Minuten, um vorteilhafte Auswirkungen einer Volumengabe widerzuspiegeln. Auf diese sollte geachtet werden, wenn die raschen Parameter der Volumenantwort keine Klärung der Situation ermöglichen. 3
5. Wie lange soll ich Volumen geben?
Wiederholte Volumengaben sollten solange erfolgen bis die systemische Gewebedurchblutung adäquat ist. Das Erkennen einer adäquaten systemischen Gewebedurchblutung erfolgt primär klinisch und erfolgt vice versa zum Nachweis einer systemischen Minderdurchblutung (siehe oben). So liegt eine adäquate Gewebedurchblutung vor wenn nur noch einer oder keiner der oben genannten Parameter vorhanden ist.
6. Wie bekomme ich das ganze Wasser wieder raus?
Nachdem eine Normovolämie wieder dauerhaft (z.B. über 24 Stunden) hergestellt wurde (siehe oben: CAVE – dynamischer Verlauf bei vielen Erkrankungen solange ein Kapillarleck besteht), gilt es, das zugeführte überschüssige Wasser wieder aus dem Körper zu eliminieren. Je ausgeprägter das Kapillarleck war und je höher die kumulative Flüssigkeitsbilanz desto ausgeprägter ist diese Notwendigkeit. Zum Erreichen einer Negativbilanz gilt es auf der einen Seite die Einfuhr zu rationalisieren (z.B. max. 1,5-2 L/d Flüssigkeit zuführen; dabei auf versteckte Flüssigkeiten wie in Antibiotika, Kurzinfusionen, Analgetika achten!) und auf der andere Seite aktiv dem Körper Wasser zu entziehen. Hierzu werden entweder
Nachlese JT 2015 ACO-ASSO
Die Thyreoidektomie en principe beim Minimal invasiven – Follikulären Schilddrüsenkarzinom (MI-FTC) – ein PRO
Evelyne Bareck – LK Oberpullendorf (Evelyne.Bareck@krages.at)
In der dritten Auflage des ACO ASSO Manuals 2011 wurde das follikuläre bzw. oxyphile follikuläre Karzinom bereits in 2 Subtypen, nämlich einerseits in das MI-FTC mit ausschließlicher Kapselinvasion und ohne Angioinvasion bzw. in jenes mit limitierter (<4) Angioinvasion, andererseits in das ausgedehnt invasive follikuläre Karzinom und das oxyphile follikuläre Karzinom, eingeteilt. Als Therapie für das MI-FTC mit ausschließlicher Kapselinvasion wurde eine Hemithyreoidektomie, bei Kapsel- und limitierter Gefäßinvasion die Thyreoidektomie ohne Lymphadenektomie und folgender Radiojodtherapie angegeben.
Zur SEER Database korrelierend sehen wir, dass das wirkliche MI-FTC deutlich seltener auftritt, als das WI-FTC (1:3), trotz nahezu identer Geschlechts- und Altersverteilung. Allerdings treten nur bei 0,5% aller MI-FTC Patienten Fernmetastasen bzw. in 0,9% Lymphknotenmetastasen auf. Das Gesamtüberleben der MI-FTC Patienten liegt deutlich über dem, der restlichen US Gesamtpopulation. Klinisch relevant als beeinflussender Faktor für das Gesamtüberleben, bzw. das erkrankungsfreie Überleben ist laut Podda et al., ähnlich den publizierten Daten von Machens et al., der Durchmesser des Tumors > 4 cm, gefolgt vom TNM Stadium III-IVa mit einer deutlich erhöhten Odds Ratio, bzw. Signifkanz. Erst sekundär kommt die Gefäßinvasion bzw. die AMES Risikostratifizierung zu tragen.
Die Frage nach dem Ausmaß der chirurgischen Strategie versuchen Sugino et al. in einer rezenten Arbeit zu klären, indem sie Pat. mit und ohne komplettierende Thyreoidektomie vergleichen. Alle Patienten mit einer Thyreoidektomie wurden einer ablativen Radiojodtherapie zugeführt. Die Ergebnisse zeigen, dass die Fernmetastasierungsrate altersabhängig steigt, weswegen diese Arbeitsgruppe die Thyreoidektomie mit folgender Radiojodablation ≥ dem 45. Lebensjahr empfiehlt, angelehnt daran, dass in der komplettierten Gruppe (n=101) keiner der Patienten an der Erkrankung verstarb, wohingegen in der Vergleichsgruppe (n=223) der nicht komplettierten Patienten 7 an einem Tumorprogress verstarben.
Auch D’Avanzo zeigt in seinen bereits 2004 publizierten Daten einen deutlichen kumulativen Überlebensvorteil, der seiner Definition nach, wirklich nur auf minimal invasive Karzinome, gegenüber dem moderat invasiven und weit invasiven FTC zutrifft. Die 10-Jahresüberlebensdaten für das MI-FTC liegen bei 97,8%, für das moderat invasive FTC bei 80% und für das WI-FTC bei 37,5%.
Konkludierend muss in Anlehnung an die Deutschen Leitlinien für die Therapie der malignen Schilddrüsenerkrankung, speziell des MI-FTC, festgehalten werden, dass eine komplettierende Chirurgie im Sinne einer Thyreoidektomie nur bei nachgewiesener Angioinvasivität unabhängig von der Anzahl der Gefäßeinbrüche zu verfolgen ist. Andererseits ist bei nachgewiesener Angioinvasion die primäre oder sekundäre Thyreoidektomie ohne Lymphadenektomie mit postoperativer Radiojodtherapie sehr wohl zu empfehlen. Noch detaillierter empfiehlt die ESES in ihrem Consensus Report 2014 eine Komplettierung des MI-FTC ab einem Alter von 45 Jahren, einem Tumordurchmesser über 40 mm, nachgewiesener Angioinvasivität, makroskopisch und radiologisch suspekten Lymphknoten und dem Vorliegen von Fernmetastasen bei Erstdiagnose.
Literatur:
Goffredo P. et al; Can Minimally Invasive Follicular Thyroid Cancer be approached as a Benign Lesion Ann Surg Oncol (2013) 20:767-772
M. Podda et al; Follicular thyroid carcinoma: differences in clinical relevance between minimally invasive and widely invasive tumors. WJSurg Oncol (2015): 13:193
A. Machens et al; The Prognostic Value of Primary Tumor Size in Papillary and Follicular Thyroid Carcinoma – A Comparative Analysis Cancer June 1, 2005 / Volume 103 / Number 11
K. Sugino et al; Does Completion Thyroidectomy Improve the Outcome of Patients with Minimally Invasive Follicular Carcinoma of the Thyroid? Ann Surg Oncol (2014) 21.2981-2986
A. D‘Avanzo, OH Clark et al; Follicular Thyroid Carcinoma: Histology and Prognosis. Cancer March 15, 2004 / Volume 100 / Number 6
G. Dionigi et al.; Minimally invasive follicular thyroid cancer (MIFTC) – a consensus report of the European Society of Endocrine Surgeons; Langenbecks Arch Surg (2014) 399:165-184
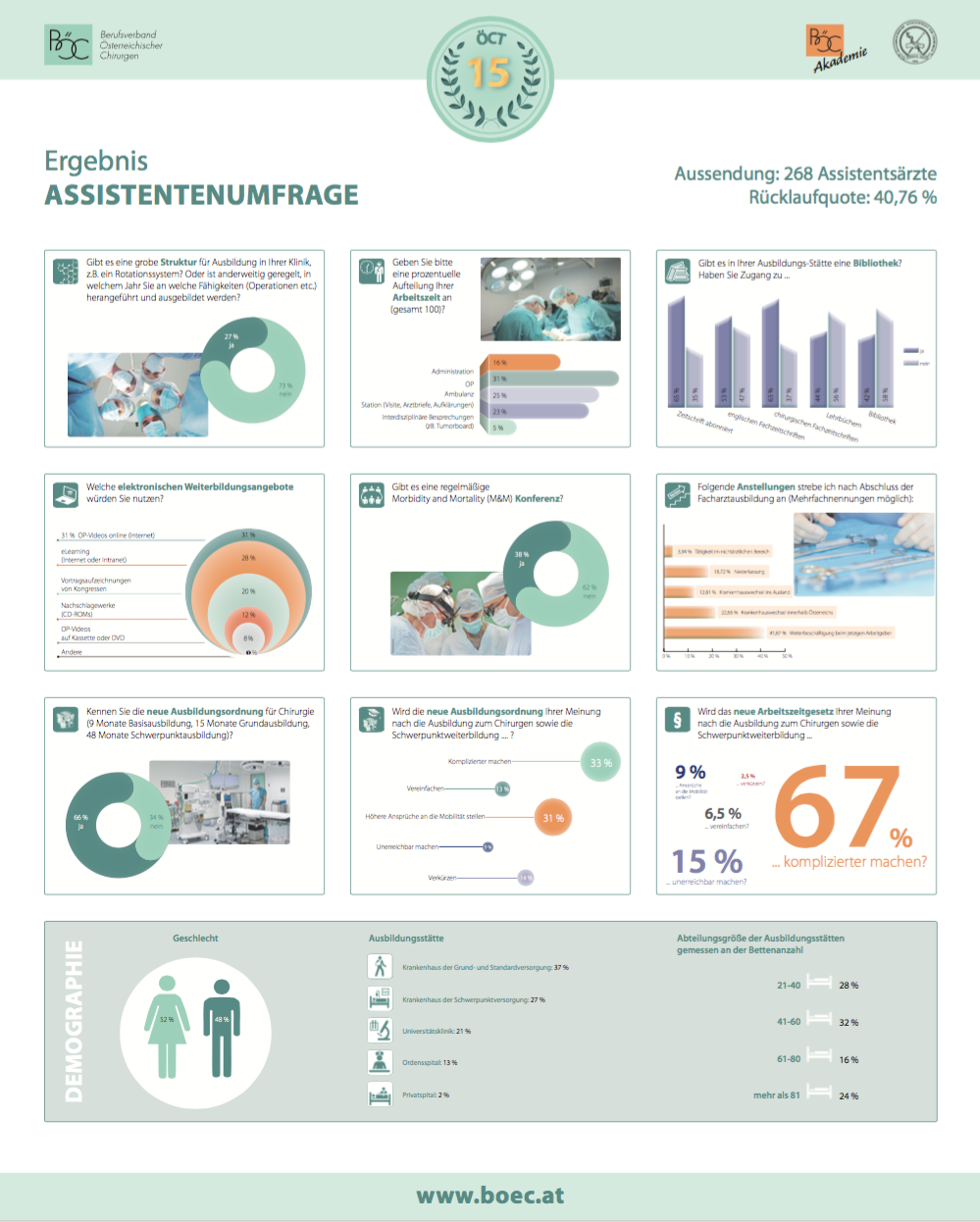
Umfrage Ausbildung zum/r ChirurgIn
Nachlese 10th International Society of Laparoscopic Colorectal Surgery
Kongressbericht
10th International Society of Laparoscopic Colorectal Surgery (ISLCRS) Congress
Laparoskopische Darmchirurgie
3. bis 6. November 2015, Singapur
von Prof.Dr.Albert Tuchmann
Der 10. Internationale Kongress für laparoskopische kolorektale Chirurgie fand vom 3. bis 6. November 2015 in Singapur, Singapur General Hospital, statt.
Am ersten Kongresstag operierten die Professoren Leroy (Straßburg), Kim (Korea), Stevenson (Australien), Law (Hong Kong), Meurette (Straßburg) und Boni (Italien). Folgende Eingriffe (Live Surgery) wurden gezeigt: 3D Rektopexie, 3D Hemikolektomie rechts mit laparoskopischer mesokolischer Exzision, Robotic Surgery (Rektopexie, anteriore Resektion), vordere Resektion mit Indocyanine Perfusion. Alle Eingriffe wurden laparoskopisch durchgeführt.
Im Folgenden wird von den Kongresstagen 1 (5. November 2015) und 2 (6. November 2015) berichtet:
Delaney (USA) über Standardisierung der laparoskopischen TME:
Er weist auf Heald hin, der in seiner Erstpublikation (TME), die an 500 Patienten erzielten Ergebnisse zeigte, wenn man statt der herkömmlichen Operation die TME angewendet hat: 3 % Mortalität, 12 % Anastomoseninsuffizienz, praktisch keine Lokalrezidive. Es kommt auf den circumferentiellen Resektionsrand an! In einer schwedischen Studie, die das norwegische Konzept (entsprechend Heald) anwendete, werden die mit der TME erzielten hervorragenden Ergebnisse hinsichtlich Lokalrezidiv dargestellt (Wibe, BJS bzw. Colorectal Disease 2003).
Die TME muss daher standardisiert sein, in USA Guidelines, in England: Lapco
Weitere wichtige Publikation zu TME: Surg. Endosc. 2011;25:1136, sowie Miskovic, Ann.Surg.2014.
SAGES: Die haben ein Skills Assessment, ….. Schritt für Schritt werden gelehrt.
Auch der Simulator spielt bei der Standardisierung eine Rolle.
Ebenso haben das Royal College of Surgeons (RCS) sowie die American Society of Colorectal Surgeons (ASCRS) ihre Standards.
Konishi (Japan) über laparoskopische D3 Lymphadenektomie beim Kolonkarzinom:
20.000 Operationen wurden erfasst.
D3 Lymphadenektomie beim Kolon heißt, dass die Arteria mesenterica superior dargestellt und lymphadenektomiert wird, beim Rektumkarzinom und D3 ist es die Arteria mesenterica inferior.
Voraussetzung: Bei T1 Tumoren sind 90 % der Patienten Lymphknoten negativ, bei T3 Tumoren nur mehr 50 %.
In die Studie aufgenommen wurden T3 oder T4a Tumore. Alle M0 (Tumorgröße unter 8 cm; es dürfte keine Ileus vorliegen, oder anders gesagt: nur UICC II und III Fälle.
Neoadjuvant erhielten die Patienten 5 FU und Leucovorin bei UICC Stadium III.
Alle Fälle wurden D3 lymphadenektomiert.
Ergebnisse: 1.050 Fälle, 550 laparoskopisch, 500 offen operiert. 30 Spitäler haben teilgenommen.
Anzahl der dissezierten Lymphknoten: 20 beim offenen, 21 beim laparoskopischen Vorgehen.
5-Jahres-Überleben: 90 % beim offenen, 91 % beim laparoskopischen Verfahren.
Detailergebnis: Die offene Chirurgie ist besser beim Befall von N2 Lymphknoten und bei Patienten mit BMI > 25.
Leroy (Straßburg) zeigt alle fortgeschrittenen Verfahren, auch kombinierte und Rendezvous-Verfahren: Polypektomie, Endomukosaresektion, Endoscipic Full Thickness Resection (Literatur Brigic BJS 2013).
Weiters Endoluminal Wedge Mechanical Resection: Der Tumor (von Leroy “nodule” genannt) wird in den Hämorrhoidalstapler „hineingedrängt“ und dann durch Schließen des Hämorrhoidalstaplers mit einer schmalen Rektummanschette reseziert.
Dann gibt es noch die Full Notes Transanal Sequential Colonic Resection (Transanale Sigmaresektion). Ein Video wird gezeigt. Ähnliches Vorgehen ist nachzulesen bei Lamm, Andreas Zerz u.a. JACS 2015;221, 789-797).
Auch eine Cörcum-Polresektion wird gezeigt mit kombinierter Koloskopie und Laparoskopie unter Zuhilfenahme eines sogenannten „Lift“, das ist ein T-förmiges Plastikstück, das in das Cöcum eingestochen wird um das Cöcum anzuheben und den Cöcum-Pol abhebeln zu können.
Wong (Singapur) über ventrale Rektopexie für Rektumprolaps:
Er weist zuerst auf die verschiedenen Symptome und Begleiterkrankungen, z.B. Rektozele, hin und erwähnt die alternativ zur Anwendung kommenden Verfahren:
- posteriore Rektopexie mit mehr als 50 % Obstipation als postoperative Folge
- Delorme, ein transanales Verfahren mit hoher Rezidivrate und hoher Rate an Stuhlinkontinenz
- Mesh-Verfahren gibt es seit Wells (1958)
- Wexner: Resektion und Rektopexie
- Ventale Rektopexie mit Mesh, die auf D’Hoore zurückgeht
Literatur bei Wong, doi 10.1111 Online-Publikation, Roboter assistiert
doi 10.1111/codi 12164, das ist eine Metaanalyse hauptsächlich hinsichtlich Komplikationen.
Es gibt ein Konsensus-Paper von Mercer Jones und D’Hoore: Colorec.Dis. 2013;16:82-89).
In einem Lunch-Symposium (Olympus) wurden die Eigenschaften von Thunderbeat und 3D Laparoskopie demonstriert.
Stevenson (Australien) berichtete über TAMIS (Transanal Minimal Invasive Surgery):
SIL hätte keinen Fortschritt gebracht, die üblichen Multicenterstudien, Color II, Classic sowie die koreanische Studie und andere werden zitiert.
Die Erstpublikationen über TAMIS sind von M. Albert sowie von Sylla und Lacy.
Es gibt noch die Termini TaTME (Transanale TME) sowie TATA ROBOT. Insgesamt kommt es in erster Linie auf eine gute Tabaksbeutelnaht an!
In Australien gibt es ein Register von 500 Fällen, siehe auch www.ausces.com.
John Marks (USA) berichtete über den Stand der Studien hinsichtlich TAMIS (bzw. TaTME):
Einige Studien werden zitiert, z.B. ACOSOOG Z6051, die Zahl der Publikationen hat zugenommen: Laut PubMed in den Jahren 2009 und 2010 je eine Studie, 2013 14 Studien, 2014 19 Studien über dieses Thema.
Zusammenfassend ist TAMIS vorteilhaft bei engem Becken, Adipositas und größerem Tumor (Bulky Tumor).
Die operierten Tumore waren duchwegs unter 6 cm und wurden mit 4500 bis 6000 Gy vorbestrahlt.
Operationstechnik (Video) mit der Diathermie wird inzidiert, dann mit der Schere zwischen Rektum und Puborektalis präpariert, dann erfolgt die Tabaksbeutelnaht.
Conclusion: Die Technik (TAMIS, TaTME, TATA) ist machbar, sowohl technisch als auch makroskopisch-pathologisch (komplette TME!). Für die Zukunft wichtig ist die Festlegung einer standardisierten Technik, randomisierte Studien sowie langzeitonkologische Ergebnisse.
Kam (Singapur) über minimal invasive Hämorrhoidektomie:
Gezeigt wird das Longo-Verfahren. Probleme des Verfahrens, zitiert aus der Literatur, seien persistierender Prolaps (10 %), dringliche Stuhlentleerung (bis zu 40 % !!!?) sowie inkomplette Entleerung. Der Referent selbst berichtet über 7000 Fälle (Longo).
Postoperative Komplikationen: Urinretention 4 %, postoperative Blutung (OP-bedürftig) 0,3 % mit insgesamt 36 Blutkonserven (bei 7000 Fällen), 1,7 % Schmerzen, 1,2 % Strikturen.
Anastomoseninsuffizienz 7 von 7000 (0,1 %).
Rezidiv 14 = 0,2 %
Laut Nachuntersuchung mit Fragebogen (n = 1835): Besserung des Leidens 95 %; 1 % Stuhlinkontinenz, dabei achte man auf glatte Muskelzellen im histologischen Präparat !!!
Tan (Singapur) über Analfisteln:
Innovative Verfahren wie verschiedene ……. verfahren sowie die Fistuloskopie und Reinigung des Fistelkanals mit einer „Bürste“ werden gezeigt.
Es folgt eine Videositzung:
Delaney (USA) hat ein Buch geschrieben mit genauer Darstellung der laparoskopischen Technik, Nettr Surgical Process 2013. Er verwendet die Schere mit elektrischem Strom um genau in der Schicht zu präparieren. Zum „Weghalten“ verwendet er einen Fan Retractor (fächerförmig), damit verhindert er das Einreißen des Mesos (er verwendet deswegen keinen „Grasper“). Das Einreißen des Meso passiert hauptsächlich bei Adipösen.
Eine Studie im NEJM von Donjer und Mitarbeitern wird zitiert; verglichen wurde Rektum offen versus laparoskopisch. Im mittleren Drittel war das offene Verfahren besser, im unteren Drittel das laparoskopische; Lokalrezidiv 11 % bei offener Technik, 4 % (!!) bei laparoskopischer.
Der Linear Stapler zum Abstapeln des Rektums wird vom Port im rechten Oberbauch eingeführt, das ist die Stelle, an der später das Ileostoma angelegt wird.
Delaney betont, dass zum Abstapeln des Rektums ein Staplermagazin, maximal zwei ausreichen sollen. Damit werden die lateralen Zipfel, „Ohren“, der Staplernaht verhindert, die bei Double Stapling Technik möglicherweise später zur Anastomoseninsuffizienz führen.
Transanale TME sollte nur bei Männern, bei BMI von etwa 40 und dem unteren Rektumdrittel durchgeführt werden; möglichst mit Häkchen und Diathermie – Delaney ist gegenüber der transanalen TME eher reserviert! Seine Patienten haben eine Lokalrezidivrate von 3 %.
Kim (Korea) berichtet über D3 Lymphadenektomie bei der Hemikolektomie rechts und bei der Hemikolektomie links (Video):
Er beschreibt eine 6-Stufen-Technik, die eine No-Touch-Isolation-Technik beinhaltet. Wichtig dabei ist die hohe Ligatur sämtlicher Gefäße (Ileokolika, Kolika media, usw.). Es wird ausschließlich mit Häkchen und „Backhand“ präpariert.
Dabei verwendet er ein Instrument, das wie ein Sauger aussieht (auch stumpfe Präparation möglich), in dem aber ein Häkchen, das vorgeschoben werden kann, integriert ist !!
Auffallend ist die Schlankheit des Patienten, wobei man den linken Ureter durch das Peritoneum durchsieht.
Law (Hong Kong), ebendort Chairman und Präsident der International Society of Laparoscopic Colorectal Surgery, berichtet von zu erwartenden Anastomoseninsuffizienzen bei ileokolischer Anastomose 2,5 bis 7 %, bei Kolon-Kolon-Anastomose 3 bis 6 %, kolorektaler Anastomose 3 bis 8 % und Rektumanastomose über 10 %. Bei der Hemikolektomie rechts macht er zwei Haltenähte, dann eine kleine Enterotomie sowie eine kleine Kolotomie zur Einführung des Linear Staplers, dann wir gestapelt, zuletzt fortlaufende Naht der Enterotomie.
Fluoreszenzangiographie: Indocyanin-Injektion zeigt gute Durchblutung sowohl des Kolons als auch des Rektumstumpfes, Literatur bei Jafari, JACS 2015.
Leakage Test: Luftinsufflation unter Wasser sowie intraoperative Koloskopie; Literatur bei Li VK (aus der Wexner-Gruppe) Surg.Endosc. 2009: routinemäßige Koloskopie !
Besonderes technisches Vorgehen: Präparatbergung durch Rektum; dazu Rektotomie, Einlage einer Wundrandschutzfolie und transanale Präparatbergung; danach Tabaksbeutelnaht am Rektumstumpf, dann Durchführung der Anastomose; Vorteil: durch Vermeidung des Double Stapling keine „Dog Ears“; dieses Operationsverfahren ist allerdings nur durch Roboterchirurgie möglich, sonst (Tabaksbeutelnaht) zu schwierig.
Boni (Varese, Italien) zeigt die transvaginale Präparatbergung, er verwendet den Terminus NOSE; n = 196 Studienfälle; transvaginale gegen transumbilikale (Minilaparotomie) Präparatbergung. Ergebnisse: Hauptvorteil beim transvaginalen Vorgehen ist der geringere Schmerz. Die Kolpotomie muss aber immer als posteriore Kolpotomie erfolgen, dann gäbe es keine Dyspareunie.
OP-Technik: Die Kolpotomie wird mit dem Diathermiehäkchen vom Bauch her durchgeführt, wobei der transvaginal eingeführte Endobag gegen das Diathermiehäkchen gedrängt wird. Die Kolpotomie (posterior !) wird betont klein gehalten, da die Vagina dehnbar ist. Eine Wundrandschutzfolie wird verwendet, ebenso eine Fluoreszenzangiographie.
Beim Mann kann die Präparatbergung transanal erfolgen, jedoch nur bei gutartigen Prozessen; am Rektum wird dann eine Tabaksbeutelnaht angelegt. Vorher wird die Andruckplatte des Circular Staplers durch den Rektumstumpf eingebracht.
Roxas (Philippinen) spricht über kolorektales Karzinom Stadium IV. Aus den Philippinen sind 20 bis 30 % der Patienten im Stadium IV, 30 bis 40 % im Stadium III; 30 % haben bereits eine Karzinosis peritonei, das 5-Jahres-Überleben beträgt beim Kolonkarzinom insgesamt 40 bis 50 %. Alle stenosierenden Rektumkarzinome bekommen vorerst ein Stoma.
Wegen der hohen Prävalenz der Karzinose gibt es relativ viel HIPEC-Patienten, etwa 30 Patienten in zwei Jahren.
Literatur Basingstoke, Moran und Cecil online doi 10.1002/bjs
Melissa Teo, Int.J.Cr.Dis. 2014;29:895-898
Pionier der HIPEC ist Sugarbaker: Surgery 1985;98:414
Nach Elias Europ.J.Surg. sowie Verwaal ist ein 5-Jahres-Überleben von 20 bis 50 % möglich. Mit der besten Chemotherapie ist ein Überleben bis zu 24 Monaten möglich. Die Ergebnisse mit HIPEC hinsichtlich medianer Überlebenszeit sind doppelt so gut wie mit der besten systemischen Chemotherapie, weil die Karzinose häufig eine rein lokale Erkrankung ist. Die Konzentration des Chemotherapeutikums am Peritoneum ist bei HIPEC 1000-fach so hoch wie bei systemischer Chemotherapie. Bei der HIPEC werden eine Peritonektomie gemacht, eine lokale Chemotherapie sowie eine Hyperthermie. Zur Beurteilung der objektiven Ergebnisse ist ein Scoring der Karzinose notwendig.
Melissa Teo (Singapur) über zytoreduktive Chirurgie und HIPEC:
WJS 2006;30:2132-2135:
201 Fälle, OP-Zeit 6 bis 7 Stunden, 5-Jahres-Überleben 40 % !!!; 36 % postoperative Komplikationen, davon die Hälfte schwer, jedoch nur 0,5 % Mortalität.
David Jayne (England) über Lernkurve bei laparoskopischer sowie Robotic Colorectal Surgery:
Insgesamt werden 5 bis 300 Fälle Lernkurve angegeben; andererseits n = 55 für Rechtsresektion, n = 62 für Linksresektion, wobei folgende Messparameter herangezogen werden: OP-Zeit, Umstieg, Blutverlust, postoperativer Aufenthalt in Tagen, Morbidität, Mortalität, Lymphknotenentnahme (Anzahl).
Literatur Kayano Surg.Endosc. 2011
Jennifer Bari: Ann.Surg.Oncol. 2014
Jedoch nur 20 (15 – 30) Fälle für Robotic.
Marks (USA): bevorzugt koloanale Anastomose, Rektumkarzinom möglichst mit Schere und wenig Strom präparieren, Präparatbergung transanal 1000 Fälle; 5 mm im Gesunden reseziert genügt; unter neoadjuvanter Chemotherapie 90 % 5-Jahres-Überleben !!
Laut David Jayne (England) gibt es seit Einführen eines nationalen Programms in Großbritannien 50 % … A Fälle !!
Stevenson (Australien) über Pelvic Floor Surgery (Rektumprolaps, Inkontinenz):
- ventrale Rektopexie
- Sphinkterrepair (80 % Erfolge)
- Gracilis-Plastik
- Phenix (wie der Magnetring bei Fundoplikatio)
- TOPAS-Sling (das ist ein Band aus Prolene)
- SNS (sakrale Nervenstimulation, Neuromodulation)
Literatur Altomare BJS; ventrale Rektopexie bei D’Hoore Surg.Endosc. 2006; 20:1919-1923
Meshes können zu Erosionen führen; persönliche Zahlen von Stevenson 231 Fälle zwischen 2008 und 2014; biologisches Mesh ist besser als Prolene hinsichtlich Rezidiv; eine komplette Remission der Stuhlinkontinenz ist in 50 % möglich; siehe auch www.ausces.com
Mittagssymposium:
Leroy (Straßburg) zeigt ein Video einer tiefen vorderen Resektion; dabei verwendet er zum Weghalten z.B. der Harnblase einen speziellen Retraktor, das ist ein 10 mm-Stiel mit einem kleinen (etwa 2 cm) abwinkelbaren Stück an der Spitze, welches L-förmig, H-förmig oder V-förmig abgewinkelt werden kann (Fa. Storz). Die Abwinkelung erfolgt mit einer Stellschraube von außen. Dadurch ist eine hervorragende Exposition des Operationsgebietes, z.B. bei der TME, möglich. Leroy nimmt dabei nur das Häkchen zum Präparieren, das Rektum setzt er mit zwei 30 mm-Magazinen ab. Vorher ligiert er das Rektum proximal der geplanten Absetzungsstelle um damit besser nach kranial ziehen zu können.
Boni (Italien) zeigt Fluorescent Lymph Node Mapping; n = 15; zeigt Metastasierungsweg mit Anfärbungen an Arteria ileocolica (Stamm) oder colica media; funktioniert ähnlich dem Sentinel Lymphknoten, der Farbstoff wird peritumoral injiziert; ICG Fluoreszenz.
Podiumsdiskussion über Roboterchirurgie:
Franklin und Leroy halten sie eher für überflüssig, Asiaten (Lee, Choi, Law, Kuo) sind dafür. Es gibt eine Rollar-Studie, die der Roboterchirurgie keinen eindeutigen Vorteil ausweist.
Nachlese ACO-ASSO JT (Schilddrüsenkarzinom)
Erweiterte und multiviszerale Eingriffe beim fortgeschrittenen Schilddrüsenkarzinom
von Rudolf Roka
Die Herausforderung bei der Chirurgie organüberschreitender Schilddrüsenkarzinome (OSC) liegt im adäquaten Resektionsausmaß um sowohl der Radikalität als auch dem Funktionserhalt gerecht zu werden. OSC weisen einen eklatant höheren Prozentsatz an histologisch aggressiven Formen auf. Die Häufigkeit liegt zwischen 4% und 7% scheint jedoch in letzter Zeit durch die hohe Rate präventiver Eingriffe zurückzugehen.
Therapeutisch anspruchsvoll ist die Infiltration in Trachea, Larynx, Hypopharynx, Ösophagus und die großen Gefäße. Die häufigste Form des OSC in den Larynx ist das An- oder Umwachsen des Nervus laryngeus recurrens, zumeist nahe seiner Einmündung in die Larynxmuskulatur.
- Bei intaktem Nerven sollte ein “Shaving” durchgeführt werden, wenn eine makroskopisch vollständige Tumorentfernung möglich ist. Eine anschließende Radio-Jod-Therapie bei differenziertem OSC ist obligat.
- Ist der Nerv bereits funktionslos ist eine Neurolyse nicht erfolgreich und der Nerv sollte reseziert werden. Die Infiltration der Trachealwand, vor allem jedoch die intramurale Tumorausbereitung ist nicht abschätzbar. Das bedeutet, dass ein „Shaving“ nur bei ganz oberflächlicher Adhärenz des Tumors zur Anwendung kommen sollte. Onkologisch am verlässlichsten ist somit die Vollwandresektion, vor allem als Querresektion. Aufgrund des Operationsrisikos ist ein derartiger Eingriff in Zusammenschau mit folgenden Faktoren abzuwägen: Allgemeinzustand, Alter und Lebenserwartung des Patienten, Histologie, Grading und Tumorstadium. Bei differenziertem OSC beträgt die Latenzzeit zwischen (inkomplettem) Shaving und therapiepflichtigem Lokalrezidiv im Mittel 67 Monate.
Nahtverschlüsse an Hypopharynx und Ösophagus sind aufgrund mangelnder Mobilisierungsmöglichkeiten Dehiszenz-gefährdet. Größere transmurale Defekte erfordern die Rekonstruktion mit frei transplantiertem Jejunum. Während die großen Venen relativ häufig von Tumor infiltriert sein können und entweder reseziert (Vena jugularis interna) oder rekonstruiert (Vena subclavia, Vena cava) werden, sind Arterien nur ausnahmsweise betroffen bzw. die Resektion/Rekonstruktion selten indiziert. Als Zugang zum Mediastinum eignet sich bei Prozessen im Mittelfeld die partielle oder totale Sternotomie, bei Prozessen im lateralen Mediastinum die partielle Sternotomie mit Verlängerung in den Interkostalraum der betroffenen Seite.
World Congress of Surgery 2015 Bangkok
von A. Tuchmann
Die Buchstaben [swv-Tu] … bedeuten „so wie ich es verstanden habe“ (nämlich beim Kongress und beim Mitschreiben – Tuchmann)
Der World Congress of Surgery 2015 fand zum 46. Mal statt (früher: International Surgical Week), 23. bis 27. August 2015, in Bangkok, Thailand.
Dieser Kongress ist der offizielle Weltkongress der Chirurgie gemeinsam mit mehreren assoziierten Fachgesellschaften (Endokrinchirurgie, Brustchirurgie, Traumachirurgie und Intensivmedizin, metabolische Chirurgie und Ernährung, I.S.D.S., usw. Der Kongress fand gemeinsam mit der Thailändischen Gesellschaft für Chirurgie statt; nicht zuletzt deswegen mehr als 2.200 Teilnehmer, davon etwa 800 aus Thailand. Die organisierende Gesellschaft ist die renommierte International Society of Surgery (ISS) / Société Internationale de Chirurgie (SIC) mit Sitz in der Schweiz, gegründet 1902 in Belgien, in den 1970er und 1980er Jahren maßgeblich gestaltet durch M. Allgöwer (siehe auch www.iss-sic.com). Das offizielle Organ der ISS/SIC ist das ebenso renommierte World Journal of Surgery, Springer Verlag, Impact Faktor derzeit 2,8.
An drei Kongresstagen (Dienstag, Mittwoch, Donnerstag) fand von 7:00 bis 8:15 Uhr ein Springer Writers‘ Workshop statt, gestaltet von John Hunter, dem Editor in Chief des World Journal of Surgery – – – Reproduzierbarkeit in Österreich ?!
Martin Allgöwer Lecture: Leadership in der Chirurgie. Brauchen wir sie, können wir sie messen? Durch Prof.Clavien, Zürich. Sehr eindrucksvoller Vortrag, ein Leader sei ein Mentor, er stehe einem Team vor, der Ausdruck gehe auf einen Herrn Warren Dennis zurück, … Beispiel Michelangelo, der 60 Mitarbeiter hatte. Aus der Kunst werden die Maler Manet, Renoir und Monet genannt, aus der Musik das Zusammenspiel eines Orchesters, in dem der Dirigent der Leader ist. In Nature wurde 2015 über Leadership publiziert (s.u.). In PubMed finden sich 800 Treffer. In der Vergangenheit waren die Eigenschaften eins Leaders: Autonomie, Autorität, Kontrolle und ein hohes Maß der Eigenidentität des Leaders. Jetzt sind Kollaboration, Evidenz, Messbarkeit und öffentliches Interesse eines Leaders gefragt. 2014 fand eine Konferenz in Zürich statt mit dem Thema „Wie wählt man einen Bewerber für einen klinischen Lehrstuhl aus?“: … geringe Social Skills können nicht kompensiert werden! Dies wurde publiziert in Clavien, Nature 2015, 519:286. Leader und Manager stehen im krassen Gegensatz, da Manager Administratoren sind, sie seien gegen uns Ärzte und hätten in erster Linie finanzielle Interessen.
Ein großer Leader ist immer in Verbindung mit einem großen Team! Früher waren Patientenversorgung, Forschung und Lehre im Vordergrund; in der Zukunft werden das Management, die Medien und Mentorship sein. Es folgte dann noch ein kurzer Streifzug, wie es in einzelnen Ländern bzw. Kulturen gehandhabt wird: In Frankreich würde als klinischer Chef eher die Nummer 2 genommen werden, der möglichst wenig Innovationen bringt, aber andererseits gibt es keine Hausbesetzungen. Die Engländer wollen überhaupt keinen Leader. In den USA fragt man sich, ob der Chairman/Leader überhaupt noch Chirurgie macht, andererseits habe er das Budget. Publikation: Oberkofler Surgery 2012, 152: 794. Die Trainees interessieren sich nur für ihre Ausbildung. Kennzeichen des „Best Hospital“: Curriculum, Skills, Training, Morbidity- und Mortality- Konferenzen. Abschließende Antwort: Wir brauchen Leadership in der Chirurgie! – so weit Clavien!!
Sitzungen Ösophagus
Vortrag Soper aus Chicago über Paraösophagealhernie: Wir brauchen ein tension free repair genauso wie bei Inguinalhernie, daher werden Entlastungsinzisionen oder ein Mesh notwendig sein.
Vortrag M.Patti ebenfalls aus Chicago: Antirefluxchirurgie. Er betont insbesondere die pulmonalen Manifestationen der Refluxkrankheit, die gelegentlich … bei der Lungentransplantation enden, sowie die Möglichkeit der Entwicklung eines Ösophaguskarzinoms. In der Diagnostik gebe es 6 impedance channels und 2 pH channels. – (swv-Tu) Zitiert wird De Meester et al.: PPIs stoppen nicht die Refluxepisoden, das schafft nur die Fundoplikatio ! Auch Adipositas führt aufgrund des Druckgradienten / Thorax-Abdomen zum Reflux, daher ist der Magenbypass mit langem Y-Roux auch gegen den Reflux gerichtet. Nebenwirkungen der PPIs (nicht restlos bewiesen): Osteoporose, Pneumonie, Arrhythmien, Clostridium difficile.
Vortrag M. Patti über Achalasie: von der Heller’schen Myotomie bis zu POEM (perorale endoskopische Myotomie), siehe Publikation Archives of Surgery 1999; 134:809; Komplikationen von Achalasieoperationen bzw. Spätfolgen sind: Reflux, Striktur. Überdies ist die Myotomie zwar ein Eingriff, aber wirksamer als die Dilatation. Patti empfiehlt primär eine Myotomie bei Achalasie durchzuführen, erst bei Rezidiv eine Dilatation!
Vortrag John Hunter aus Portland, Oregon, über Ösophaguskarzinom: Er bringt Historisches über Ösophaguskarzinomchirurgie, u.a. Torek, aus dem German Hospital in New York, 1913: Er hat einen sogenannten „Rubber“-Ösophagus durchgeführt, eine externer Schlauch, durch den die Nahrung mechanisch in den Magen transportiert wurde.
Weiters wurden zitiert: McKeoen (?), Akiyama aus Japan, Perrachia aus Italien und De Meester aus USA: Operationsmethoden, wie sie auch heute noch stattfinden. Ferner Orringer, der grundsätzlich transhiatal ösophagektomiert hat. Publikation Omloo 2007: Es bestünde kein Vorteil, wenn mehr Lymphknoten entfernt werden.
Und schließlich 3-Feld-Ösophagektomie …, die auch Luketich anwendet, dem Pionier (und größte Fallzahl) der thorakoskopisch – laparoskopischen Ösophagektomie: 222 Fälle von 1996 bis 2002, Mortalität 1,4 %.
Weitere Vertreter der minimal invasiven Chirurgie beim Ösophaguskarzinom: Cuschieri 1992, Hunter 1995, d’Allemagne 1995 mit einer Operationszeit von 12 Stunden (!!), publiziert von Jobe und Hunter in den 20ern. 1946 hat Ivor Lewis noch von „suturing the unsuturable (= Ösophagus)“ gesprochen, was die Schwierigkeit der Operation bis heute gut kennzeichnet.
Bei der 3-field-Lymphadenektomie sind jedenfalls Arteria hepatica, Arteria lienalis und Truncus coeliacus komplett von Lymphgewebe befreit (Foto). Von technischer Seite wird noch auf die notwendige Fixation des Conduits (Colon) hingewiesen.
Sitzungen Pankreas, Gallenwege
Vortrag eines Dr. Ingkakul aus Thailand über IPMN: Wichtig ist die Unterscheidung zwischen den verschiedenen Typen des IPMN: Main duct, mixed type, branch duct. Der main duct ist 5 bis 9 mm weit, ab 10 mm spricht man von high risk mit 62 % Malignität; im Gegensatz dazu hat der branch duct-Typ eine Malignität von 24 %. Man unterscheidet low grade Dysplasie von intermediate und high grade-Dysplasie. Publikation über Biomarker: Annals of Surg. Oncology 19: 357 Seo, Ann. Surg. 2015 in Druck Adsay, V: Ann. Surg. 2015 Fernandez Castillo Gastroenterology 2010 besonders erwähnenswert sind die Guidelines von Tanaka, publiziert in Pancreas 2011; 40:581 und Pancreatology 12: 183 (2012), Diagnostik: Fritz, Ann. Surg. 2014; 250:848 sowie Sahora (stammt aus der Wiener Chirurgischen Klinik?) aus dem Massachusetts General Hospital (MGH): Surgery 2014; 156:611, sowie ebenfalls Sahora aus Ann. Surg. 258:456 und schließlich Kang, Ann. Surg. 2014:250
Vortrag Asbun, Mayo Clinic Florida über laparoskopische Resektion von Pankreasprozessen: von 2009 bis 2015 habe er 200 Duodenopankreatektomien gemacht, 50 % offen, 50 % laparoskopisch. Linksresektion 151 Fälle, davon 90 % laparoskopisch. Whipple laparoskopisch gibt es weniger als 500 Fälle weltweit, Operationszeit 6 bis 7 Stunden, Pankreasfistel 9 %, Blutungskomplikationen um 10 %. Die Daten von NSQIP (das ist das amerikanische Qualitätssicherungs- und – verbesserungssystem) sagen, dass das laparoskopische Verfahren schlechter abschneidet hinsichtlich Operationszeit, Sepsis, Reoperation und Mortalität. Asbun führt eine Ductus-mucosa-Anastomose durch.
Izbicki über fortgeschrittenes Pankreaskarzinom (das ist sein Standardvortrag): die Geister scheiden sich an der Arterie! Da gibt es eine Publikation seines Mitarbeiters Bockhorn. Nach Büchler seien Arterienresektionen nicht sinnvoll. Neoadjuvante Therapie: Literatur bei Katz (M.D.Anderson, USA): nur in 0,8 % erfolgreich (Januar 2013), Therapie mit Folfirinox + Gemcitabine. – Erfahrungen und Literatur auch bei W.Scheithauer aus der Wiener Klinik(Onkologie), Anm. Tuchmann.
Gallengangsverletzungen bei laparoskopischer Cholezystektomie: pro Jahr gibt es 3000 bis 5000 Verletzungen des Hauptgallenganges (in USA?, weltweit?), daher gibt es Guidelines der SAGES (der laparoskopischen Chirurgenvereinigung Amerikas): siehe deren Homepage: www.sages.org
Vortrag eines Herrn Bakens aus Holland: große Studie einer landesweiten Ermittlung über die Behandlung des Pankreaskarzinoms in Holland (hat doppelt so viel Einwohner wie Österreich): Die Diagnose wurde 16.000 mal gestellt. M0 – Fälle, d.h. ohne Metastasen, gab es nur bei 43 %, wobei im Zentrum 50 % chirurgisch behandelt wurden, in Nicht-Zentren nur 30 % chirurgisch behandelt wurden. Das 5-Jahres-Überleben ist im Zentrum mit 12 % signifikant höher als im Nicht-Zentrum. Allgemein ist das mediane Überleben beim Pankreaskarzinom 4 bis 6 Monate, das 5-Jahres-Überleben maximal 4 %, operabel sind 20 % bei Diagnose. Die Mortalität war innerhalb dieser Studie 14% im Nicht-Zentrum, 3 % im Zentrum(!!). In Holland gibt es 93 Spitäler, in 89 Spitälern (Österreich hat offensichtlich die doppelte Spitalsdichte; Die Niederlande haben doppelt so viel Einwohner wie Österreich) wurde die Diagnose Pankreaskarzinom gestellt, 19 Spitäler davon waren Zentren mit mehr als 20 Duodenopankreatektomien pro Jahr.
Interessanter Vortrag eines Herrn Singh aus Auckland, Neuseeland: Randomisierte Studie über perioperatives Simvastatin (einem Lipidsenker) bei kolorektalen Operationen. Es gibt da einen positiven Effekt, der mir aus einer Publikation im Journal des American College of Surgeons (JACS, ca. 2012?) bekannt ist. Die antiinflammatorische Antwort ist erhöht, aber die Komplikationen sind gleich wie ohne Simvastatin. Publiziert wurde dies im Journal of Colorectal Disease, Singh 2012.
Eine Frau Brown aus Thailand über Bildgebung bei primären und metastatischen Lebertumoren: Das HCC sollte möglichst unter einer Größe von 2 cm diagnostiziert werden. Wenn CT und Kontrastmittel- Enhancement positiv sind, dann ist eine Biopsie nicht notwendig! Bei MR und positivem Enhancement ist genauso eine Biopsie nicht notwendig. Das stehe auch in den Guidelines.
Sitzung über Surgical Education, Andrew Warshaw, Boston, dzt. Präsident des American College of Surgeons (ACS): gesprochen wurde über das amerikanische System: ABS (American Board of Surgery); Domain; 8 Competences; Überprüfung von practice behaviours sowie medical knowledge und einiges mehr. (swv-Tu) Die Kompetenzen teilen sich wieder in Subkompetenzen und Grading, die Subkompetenzen unterscheiden ein Level (Leistungsstufen) 1 bis 4 und diese werden alle 6 Monate geprüft. Es gibt schriftliche Tests und es gibt vor allem einen Programm Director, der ständig das Erlernte hinterfragt und begleitet. Patient care ist von größter Wichtigkeit. Es gibt ein Clinical competence committee (CCC): dieses besteht aus dem Programm Director und 3 bis 4 anderen. Dieses Komitee prüft alle 6 Monate den Fortschritt der Ausbildungsassistenten(s.o.) Besonders wichtig sind sogenannte „soft areas“, surgery milestones, Simulationen mit Schauspielern, die Patienten darstellen, sowie Team Training. Die simulierenden Schauspieler werden videoaufgezeichnet. Dieses neue Curriculum ist seit einem Jahr in Kraft.
Danach hat Frau P. Numann, die Präsidentin des ACS von 2012, gesprochen: ABMS (American Board of Medical Specialization, n = 24) – in Österreich gibt es 41 Sonderfächer. Die Berufswahl (z.B. Chirurgie) wird vom Charakter und vom sozialen Status beeinflusst!! Die Rolle der Frau gewinnt in der Chirurgie an Bedeutung.
Besonders interessant war ein Vortrag über das System in Irland eines Herrn Magee: Es gibt dort ein 8-Jahres-Programm, wobei den Ausbildungsassistenten jedes Jahr eine Woche Überprüfung, Feedback, Unterricht und skills training geboten wird. Es handelt sich um ein nationales Programm des RCSI (Royal College of Surgery Ireland). Es gibt interaktive Vorlesungen, Geschicklichkeitstraining, z.B. Knoten, Thoraxdrain setzen, Laparoskopie, Endoskopie sowie sogenannte „klinische Szenarien“. Dies ist publiziert im American Journal of Surgery 2013 (?), Autor: Heskin: Impact of education national program.
MSurgery ist eine App, siehe auch Twitter. Geboten werden basic skills, minor procedures, surgical anatomy: www.msurgery.ie, kommt also auch aus Irland!
Sitzungen kolorektale Chirurgie
Vortrag von Dindo/vertreten durch Hahnloser, beide Schweiz. Die Klassifikation von Komplikationen geht auf Clavien, Surgery 1992, zurück, gefolgt von Dindo, Ann. Surg. 2004. Unter Komplikation versteht man einen Qualitätsverlust hinsichtlich Struktur oder Prozess oder beim Outcome. Komplikation ist auch jedes Abweichen von der Norm, nach Definition Clavien/Dindo. So gibt es 56 Definitionen von Anastomoseninsuffizienz! Die Clavien-Dindo-Klassifikation von Komplikationen sieht so aus: Grad I: keine spezifische Therapie Grad II: benötigt Medikamente Grad III: benötigt Endoskopie oder chirurgische Intervention, IIIa in Lokalanästhesie, IIIb in Allgemeinanästhesie Grad IV: diese Komplikation ist bereits intensivpflichtig, lebensgefährlich; IVa 1- Organversagen, IVb Mehr-Organversagen Grad V: diese Komplikation ist tödlich
Danach hat Ljungqvist aus Schweden über Fast Track und Komplikationsvermeidung referiert: Im englischen Sprachgebrauch herrscht das Wort ERAS (Enhanced Recovery after Surgery) vor. Dabei wird die metabolische Antwort auf den chirurgischen Stress besonders hervorgehoben, die Insulinresistenz ist geringer. Daher soll man präoperativ Kohlenhydrate in Form von Getränken verabreichen, dadurch weniger Stress, weniger Komplikationen und geringere Mortalität. Sedativa verringern ebenfalls die Insulinresistenz; die Epiduralanästhesie allerdings hebt die Insulinresistenz an! Die chirurgische Komplikationsrate wird jedoch nicht reduziert. Fragen der Zukunft: Chirurgische Komplikationen? sowie Langzeitergebnisse, v.a. onkologisch?
Vortrag Hahnloser aus Lausanne über das Management von Anastomoseninsuffizienzen: Diese kommen zu 2 bis 16 % vor, zitiert nach Buchs aus Genf, International Journal of Colorectal Disease. 33% der Patienten enden mit einem permanenten Stoma. Nach ausgeheilter Anastomoseninsuffizienz kann ein sogenannter „persistent sinus“ (einer Retention entsprechend) zurückbleiben. Risikofaktoren für eine Anastomoseninsuffizienz sind: männliches Geschlecht, tiefe Anastomose, präoperative Radiatio (eine Metaanalyse aus 100.000 Fällen). Endo-Sponge: Literatur bei Riss, Colorectal Disease 2010.
Kitano, Japan, Endoskopische Resektion: ESD im Kolon. Fallzahlen 500 bis 1.500 in Japan (mehrere Spitäler): Eine En-bloc-Resektion gelang in 90 %, Komplikationen: Blutung und Perforation je etwa 2 %; Rezidiv 2 %; 5-Jahres-Überleben: 95 %. Submucosakarzinome gibt es schon weniger: n = 387; 11 Rezidive; 13 Fernmetastasen.
Vortrag von H. Kessler, Cleveland, früher Erlangen, über Überlebensverbesserung am Kolon: Schilderung der auf Hohenberger zurückgehenden Technik der mesokolischen Exzision in Anlehnung an die TME durch Held. Am Rektum gibt es mehrere Möglichkeiten: die TME, die auch transanal durchgeführt werden kann (TAMIS), die neoadjuvante Therapie, das Watch-and-wait-Verhalten, wenn der Primärtumor durch neoadjuvante Therapie T-0 ist (also nicht mehr sichtbar, Komplette Remission), die Roboteranwendung sowie das extralevatorische Verfahren. Beim Rektumkarzinom kann daher ein sogenannter „tailored approach“ angewendet werden. Aus der Geschichte 1908 Moynihan, später Jamieson, später Schmieden in Frankfurt 1940. Diese hatten bereits die Idee der Chirurgie nicht nur des Organs sondern auch des Lymphabstromgebietes. 1967 bzw. 1970 kam Turnbull mit seiner No-touch-isolation-Technik: Er machte einen retrospektiven Vergleich seiner sicher sehr guten Operationstechnik mit der vermutlich insuffizienten Operationstechnik seiner Partner, die „konventionell“ operierten: daraus leitete er den nicht ganz richtigen Schluss, seine Technik sei die bessere.
Die Rektumchirurgie wurde durch die TME (Heald) entscheidend verbessert, während die Ergebnisse am Kolon gleich (schlecht) blieben. Hohenberger sieht in der totalen mesokolischen Exzision einen Vorteil. Dazu muss man wissen, dass anatomisch parakolische, intermediäre und zentrale Lymphknoten unterschieden werden.
Beim Kolonkarzinom im Stadion III gibt es in Deutschland bis 39 % Lokalrezidive!! – In Erlangen hatten 84 % der Patienten ein rezidivfreies Überleben durch die totale mesokolische Exzision. Das Survival konnte andererseits von 62 auf 81 % gehoben werden. Quirke, das ist der Pathologe von Heald, fand im sogenannten Clasicc Trial, dass im Stadium III nur 22 % der Operierten am Mesokolon eine erstklassige Resektionsqualität hatten! – Literatur Bentelsen, Lancet Oncol. 2015; 16: 161: unter den Bedingungen der totalen mesokolischen Exzision wurde in allen Stadien des Kolonkarzinoms ein besseres Survival erzielt; es ergab sich jedoch kein Unterschied zwischen konventioneller und laparoskopischer Operation.
Kessler sagt in der Diskussion, dass er adipöse Patienten lieber offen operiere, weil durch den Zug am Kolon bei der laparoskopischen Operation immer wieder Risse am Gewebe auftreten würden. Er verweist dabei auf die interessante Feststellung (Vortrag) von Bemelman, dass bei Anwendung des Kolonstents schlechtere Ergebnisse als bei der Operation erzielt werden würden, da offenbar Tumorzellen durch die Kompression durch den Stent „ausgepresst“ würden.
Vortrag You, vorgetragen von Fichera, aus USA über Robotic: Die offene Operation sei besser. Diskussion (Bergamaschi): durch Robotic sei die mesorektale Exzision besser durchführbar.
Vortrag Fichera über Frühkarzinom des Rektums: Bei T1 lokale Exzision, bei T2 Radikaloperation, T3 und T4 neoadjuvante Therapie, Endosonographie notwendig. Moore 2008: Lokalrezidiv nach lokaler Exzision 16 %, nach TEM nur 2 %. Endosonographie ist gut für frühe Stadien, MRI besser für fortgeschrittene Stadien wegen Beurteilung von Prostata und Harnblase.
Bemelman, Niederlande, Lokalrezidiv beim Rektumkarzinom ist in Holland 5 % in Folge der Spezialisierung / Zentrumsbildung! Für T4-Fälle (Rektumkarzinom) gibt es bereits Literatur, dass laparoskopische Chirurgie möglich ist.
Sitzungen minimal invasive Therapie und was in der Zukunft alles möglich sein wird
Hahnloser über TEM, TEO (transanal endoscopic operation) und TAMIS (transanal minimally invasive surgery): z.B. über GelPort mit normalen laparoskopischen Instrumenten. In Frage kommen Läsionen zwischen 4 und 20 cm ab Linea anocutanea. Die Naht an der Rektumwand (nach TEM oder TAMIS) ist mit V-loc-Faden möglich. Hahnloser vermeidet die peace-meal-Technik.
Soper aus Chicago über NOTES: Er erwähnt das deutsche NOTES-Register mit 2.100 Fällen; geschätzt wurden bisher 10.000 transvaginale Eingriffe durchgeführt. Es gibt randomisierte Studien aus Homburg, Köln mit etwa 20 zu 20 Fällen, publiziert in Annals of Surgery. Beim transvaginalen Vorgehen gibt es weniger Schmerzen. Aber: Soper sieht keinen Sinn darin, er hat mit NOTES aufgehört („We have stopped doing it“)! Auch bei Neto in Brasilien gab es keine Fälle im letzten Jahr. Literatur Schwaitzberg, Surg. Endoscopy 2015 in Druck (das ist aus der Klinik von Soper): Multicenterstudie von 6 Kliniken, seit Ende der Studie sind keine NOTES-Fälle mehr operiert worden!! Vortrag von Soper (Chicago) über POEM (peroral endoscopic myotomy) bei der Achalasie. Nebenwirkung Reflux!?, daher eventuell eine 180-Grad vordere Fundoplikatio nach Dor ergänzen; diese Fundoplikatio würde die Myotomie „offen halten“. Bei der Heller’schen Myotomie wird der Ösophagus mobilisiert, daher ist postoperativ ein Reflux möglich. Technik von POEM: endoskopische Inzision der Mucosa, dann Tunnel zwischen Mucosa und Muskularis bilden, Myotomie, dann Verschluss der Mucosa. 150 Fälle wurden von Soper und Mitarbeitern operiert, Publikation Hungness 2013 sowie Teitelbaum, Surg. Endoscopy 2014: Die Ergebnisse sind nicht gut, nur 80 % Erfolg, 37 % Reflux, die Lernkurve beträgt etwa 15 Patienten.
Achalasie Typ III: spastische Achalasie = „Korkenzieherösophagus“.
Sitzungen Leber
Vortrag Belghiti über Leberresektion: Die Leber ist das größte Organ (2 % des Körpergewichts) des menschlichen Körpers. Op-Risiko Nr.1 ist die Blutung, da die Leber einen doppelten Inflow durch Arterie und Pfortader besitzt. Der Blutkonservenverbrauch wurde von 1995 auf 2005 von 50% auf 20% gesenkt. Op.risiko Nr.2 ist das Leberversagen. 30% Lebervolumen ist die kritische Grenze (swv-Tu); fulminantes Leberversagen ist möglich – dagegen auxilliäre Lebertransplantation (LTX). Recovery hängt von Volumen und Funktion ab. Die Leber ist das einzige Organ mit dieser Regenerationsfähigkeit. Regeneration ist innerhalb einer Woche möglich, außer bei Pfortaderthrombose (s.ALPPS). Preoperative liver volume modulation: Pfortaderokklusion radiologisch oder ALPPS: Hepatotomie und Unterbindung aller Gefäßverbindungen zwischen rechtem und linkem Leberlappen. Eine Leberresektion bis zu 3 Segmenten hat eine geringere Mortalität, ab 4 Segmenten steigt die Mortalität an (Lit.s. Jarnagin). Das Segment 7 ist am schwierigsten zu operieren, 2 und 3 (linker Leberlappen) sind am leichtesten. Die Qualität des Parenchyms (Fibrose, Steatose,…Zirrhose) ist entscheidend, ebenso Gefäßveränderungen, portale Hypertension, Diabetes, Adipositas oder Veränderungen durch Chemotherapie. Mortalität im eigenen Bereich 3 bis 4 % bei 800 bis 1.500 Fällen. In Japan wurden Serien von 1.000 Fällen ohne Letalität publiziert. Weitere Lit. Jarnagin, n=1800!
Minimal invasive Leberchirurgie ist hauptsächlich am linken Leberlappen durchführbar. Was man vermeiden soll, sind unnötige Leberresektionen. Durch verfeinerte Diagnostik ist bei folgenden Erkrankungen keine Indikation mehr zur Resektion gegeben: FNA, Adenome bis 5 cm, Angiome; für diese Patienten ist die Chirurgie das einzige Risiko !! Nicht kolorektale Lebermetastasen: Resektion ist möglich, aber sinnvoll? Der anteriore Approach ist besser, weil die Leber nicht komprimiert wird (auch onkologisch besser); Liver hanging maneuver. Die No-touch-Technik wurde von Peter Neuhaus beschrieben. Anatomische Resektionen sind besser als lokale Exzisionen (Eguchi). Der intraoperative Ultraschall ist wichtig für Resektion im Gesunden, 1 cm im Gesunden reicht. Essentiell wichtig in der Leberchirurgie (Onkologie) ist ein negativer Resektionsrand!
ZUSAMMENFASSEND war der World Congress of Surgery eine sehr positive Erfahrung mit großem Fortbildungswert. Es wurde das richtige Maß zwischen praktisch wichtigem Wissen, Wissenschaft und Kommunikation vermittelt. Technik und Organisation waren sehr gut, desgleichen ausreichend Zeit zur Diskussion. Nächste Weltkongresse für Chirurgie Sommer 2017 in Buenos Aires, 2019 in Krakau.
Kongressbericht Viszeralmedizin 2015 Leipzig
16. bis 19. September 2015, Leipzig
Bunt Gemischtes aus der Chirurgie
von Albert Tuchmann
Der Kongress hatte etwa 3.800 Teilnehmer, Gastroenterologen, Endoskopiker und Chirurgen, letztere etwa 1.200. Er ist eine gute Alternative zum Deutschen Chirurgenkongress, der jeweils im Frühjahr stattfindet. Die DGAV tritt etwa in gleicher Stärke auf wie bei der Frühjahrstagung.
Es gab zahlreiche Workshops und Kurse im Vorfeld des Kongresses (Mittwoch), zahlreiche Lunchsymposien und Satellitensymposien.
In Berlin Charité werden Magenkarzinome bereits standardmäßig laparoskopisch operiert, außer T4-Fälle; Kontaktadresse beim Verfasser. Zwei Sitzungen der CAJC (Chirurgische Arbeitsgemeinschaft Junge Chirurgie) fanden statt, es wurde dabei diskutiert, ob kaufmännische Kenntnisse für chirurgische Führungskräfte (Chef- und Oberärzte) notwendig sind. Ansprechpersonen ebenfalls beim Verfasser.
Sitzung über Highlights aus der Viszeralchirurgie, entspricht einem Extrakt des sogenannten „Updates“, das in Berlin und Mainz jedes Jahr stattfindet. Prof. Werner, München, berichtet über Milestones der Chirurgie: TAMIS, mesokolische Resektion bei der Hemikolektomie rechts (Literatur Bertelsen), eine Mulitcenterstudie Pankreatogastrostomie versus Pankreatojejunostomie (Literatur bei Keck), Pasireotid (ähnlich Somatostation) zum Fistelverschluss bei Pankreasoperationen, Folfirinox präoperativ, also neoadjuvant, vor Pankreaskarzinomoperationen (Autorin ist eine Christina Ferrone aus dem MGH). An der Leber gibt es noch eine Studie über PET-CT und Lebermetastasen und aus der Transplantation,.. den Spender auf 34 Grad abkühlen bringt bessere Ergebnisse.
Im Lancet 2015 wurde ein Fall Uterustransplantation von einer 61-Jährigen auf eine 38-Jährige publiziert. Diese bekam nach 31 Monaten ein Kind!
Ösophagus: CROSS-Studie neoadjuvante Therapie gegen eine Nullgruppe; das mediane Überleben hat sich dadurch von 24 auf 48 Monate erhöht.
Aus der Endoskopie: Der Endocuff steigert die Adenomdetektionsrate und schließlich von praktischem Wert: Die Post-ERCP-Pankreatitis wird durch Diclofenac sowie durch Hyperhydrierung maßgeblich gesenkt.
Sitzung CAJC (Chirurgische Arbeitsgemeinschaft Junge Chirurgie):
Vortrag von Fichtner-Feigl, Regensburg, über den optimalen Werdegang eines akademischen Chirurgen aus seiner Sicht: zuerst Common Trunk, dann Labortätigkeit mit konkreter Fragestellung! Für ein Fellowship in den USA muss man sich bewerben, man muss Facharzt sein, das ECFMG (das ist die amerikanische Nostrifikation) haben und außerdem einen Sprachtest vorweisen können. Es gibt viele Bewerber. Idealerweise folgt auf die Labor- oder Researchtätigkeit dann die eigentliche Facharztausbildung, wobei die Wissenschaft dann so betrieben wird: Leitung von Projekten, die Arbeit machen z.T. andere, Aufstellen von Drittmitteln usw.
Büchler über fortgeschrittenes Pankreaskarzinom, siehe auch Hartwig, Surgery 2014:
Es ist alles definiert (im Gegensatz zu anderen Meinungen), lokal fortgeschritten, metastasiert.
Hinsichtlich Gefäßrekonstruktion: Die Vene ist kein Problem, siehe auch Zhou, WJS 2013 (?).
Die Milzarterie eignet sich gut als Ersatz für die Arteria hepatica. Der Arterienersatz, der derzeit problematisch ist, wird in fünf Jahren möglicherweise kein Problem mehr sein. Die Mortalität von Arterienrekonstruktion bei Pankreasresektion liegt zwischen 6 und 7%. Literatur dazu: Mollberg, Ann.Surg. 2011.
Büchler berichtet über 613 erweiterte Pankreasresektionen mit Gefäßrekonstruktion (80% davon Pfortader, 15% Arterie) und hat diese Fälle mit 1.200 Standardresektionen verglichen: Mortalität 4 respektive 1,8%, Fünf-Jahres-Überleben 12% gegenüber 21%.
Ferner berichtet Büchler über 144 M1 (Fernmetastasen) –Fälle: Die Patienten profitierten signifikant von der Resektion des Primum (Selektion ??).
Insgesamt wurden in Heidelberg 8.500 Fälle in 14 Jahren operiert, das sind 70 pro Monat oder drei Whipple-Operationen pro Tag, die Mortalität lag bei 3,3%.
Neoadjuvante Therapie beim lokal begrenzten Pankreaskarzinom: Vortrag von T.Seufferlein, Ulm, der auch die Leitlinien an vorderster Stelle mitentwickelt hat. Neue Therapien mit Paclitaxel und Gemcitabine, ferner Folfirinox. Das Problem beim Pankreaskarzinom ist das Stroma, in das das Zytostatikum schlecht eindringt. Dafür eignet sich Folfirinox aber besser als platinbasierte Präparate. Literatur bei Waddel, Nature 2015, mit Genmutation!
Insgesamt bekommen 80% aller Pankreasresezierten Chemotherapie, die meisten aber erst nach 12 Wochen und das ist das Problem, weil die Chemotherapie zu spät einsetzt, da die Patienten so lange benötigen um sich von dem Eingriff zu erholen.
Chantrill, Clin. Cancer Res. 2015, 21: 2029 über Sequenzierung
Noch ein Beitrag über Pankreaskarzinom von Prof.Uhl, Klinikvorstand in Bochum:
Literatur Ravikamar, JACS 2014, 1.500 Fälle von Pfortaderresektion. Arterienresektion: kein wesentlicher Benefit, zitiert Mollberg Ann.Surg. 2015. Uhl berichtet allerdings über einen Fall mit zwei Lebermetastasen, beide reseziert, Chemotherapie mit Gemcitabine und Oxaliplatin; 8 Jahre rezidiveren! Ein weiterer Fall nach 4 Zyklen Folfirinox war der Tumor verschwunden, eineinhalb Jahre später allerdings Rezidiv.
Eine Umfrage des Berufsverbandes Deutscher Chirurgen (BDC) über die Generation Y hat ergeben: Das Wichtigste ist ihnen die Ausbildung (91%), den Baby-Boomern war die Ausbildung nur zu 50% wichtig.
Zystische Läsionen des Pankreas: Serös (geringes malignes Potential) versus Muzinös (CEA erhöht). Diagnose: Endosonographie plus Punktion plus CEA. Seröse zystische Neoplasie entspricht in ihrer Dignität der FNH der Leber, ist nie (?) maligne, kommt nur bei Frauen vor. Muzinöse zystische Neoplasie (MCN): Auch nur bei Frauen, ist eine OP-Indikation.
IPMN: Intraduktale papilläre muzinöse Neoplasie, es gibt Hauptgang-, Seitengang- und gemischte Typen; Sendai 2006 – Kriterien
Karzinome in der chronischen Pankreatitis sind wahrscheinlich alle IPMNs.
Multifokale Seitengang-IPMNs ohne Knoten können observiert werden. Seitengang-IPMN über 3 cm und symptomatische IPMNs sind eine OP-Indikation.
Fukuoka 2012-Klassifikation, publiziert bei Tanaka Pancreatology 2012 sowie Sahora u.a. Ann.Surg. 2013.
Malignitätskriterien: Wenn in der Endosonographie der Hauptgang erweitert ist (über 10 mm), Knötchen, dicke Wand, atypische Zytologie. Dann gibt es noch die Worrisom-Kriterien (Gangweite ?)
Malignität: Hauptgang IPMN in 60 bis 90% maligne, Publikation 600 Fälle von IPMN bei Hackert (aus der Büchler-Gruppe), Ann.Surg. 2015. Bei 5 bis 9 mm Hauptgangweite sind 35% maligne, bei Seitengang-IPMN nur etwa 20%.
Noch ein Vortrag zur neoadjuvanten Therapie:
Die Überlebensrate des Pankreaskarzinoms ist insgesamt etwa 6%, früher waren es 2,4%; bei den resezierten überleben 20% fünf Jahre; bei 3 cm Tumorgröße gibt es bereits in 94% Metastasen; 60% der RO-Resezierten haben nach 6 Monaten ein Rezidiv !! – Daher Forderung nach einer neoadjuvanten Therapie; diese sollte früh einsetzen, andererseits geht es den Patienten postoperativ oft schlecht.
Es gibt unterschiedliche Definitionen für Borderline-Befunde.