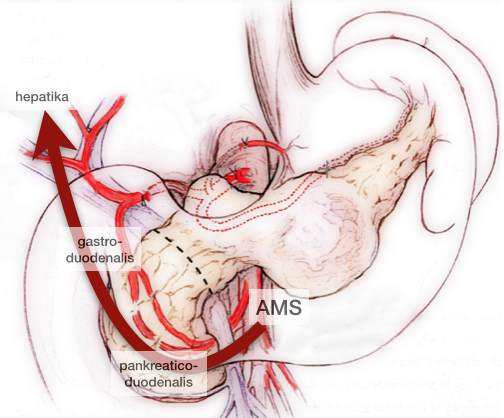
Adhäsionen stellen ein signifikantes Problem nach abdomionellen Eingriffen, Verletzungen des Peritoneums, dar. Daher wäre eine Adhäsionsprophylaxe sinnvoll.
Ten Broek RP et al. Benefits and harms of adhesion barriers for abdominal surgery: a systematic review and meta-analysis. Lancet. 2014;383:48-59
Okabayashi K et al. Adhesions after abdominal surgery: a systematic review of the incidence, distribution and severity. Surg Today. 2014;44:405-20
Adhäsionen werden in 4 Grade eingeteilt:
Grad I: leicht, stumpf trennbare Organverklebungen
Grad II: festere, noch stumpf oder scharf lösbare Verwachsungen
Grad III: feste Organadhäsionen, Stränge. Nur scharf lösbar, deutliche Vaskularisation, Organgrenzen erkennbar.
Grad IV: feste, flächenhafte Organverwachsungen, vaskularisiert, Organgrenzen nicht erkennbar, nur scharf trennbar und Organverletzungen sind nciht zu vermeiden.
Zühlke HV et al. Pathophysiology and classification of adhesions. Langenbecks Arch Chir Suppl II Verh Dtsch Ges Chir. 1990:1009-16
Die Stadien der Adhäsionsbildung, in Analogie zur Wundheilung, können wie folgt beeinflusst werden, wobei das atraumatische operieren, Spülungen und physikalische Adhäsionsbarrieren etabliert sind.
1. OP-Trauma —> atraumatisches operieren, Laparoskopie (Reduktion um 25%)
2. Entzündungsreaktion —> (Kortikosteroide, NSAR, Antibiatika)
3. Fibrinogenese —> Spülungen
4. Verklebung —> physikalische Adhäsiosnbarrieren (Hyaluronsäureester, Zellulose, u.a.)
5. unvollständige Fibrinolyse —> (Streptokinase, tPA)
6. Fibrinorganisation —> (TGF-ß u.a.)
7. permanente Adhäsion
Nach der derzeitigen Datenlage ist eine primäre Adhäsionsprophylaxe, außer gewebeschonendes Präparieren, nicht zu empfehlen. Nach adhäsionsbedingenten Relaparotomien scheint eine feste Barrieretrennung im kleinen Becken (vor allem von GynäkologInnen bevorzugt) und eine allgemeine Barrieretrennung durch Flüssigkeit möglich. In einzelnen Kliniken wird dies durch Instillation von intraabdomineller Flüssigkeit mit Drainagen während des posoperativen Verlaufes gewährleistet. Es gibt keinen direkten Vergleich zur Wirkung und Nebenwirkung (Anastomsendehiszenzen etc.)
Nach > 6 Voroperationen ist bei einem erneuten Eingriff mit bis zu 85 % iatrogenen Darmeröffnungen zu rechnen – mit allen möglichen Folgen einer Peritonitis
Van Der Krabben AA et al. Morbidity and mortality of inadvertent enterotomy during adhesiotomy. Br J Surg 2000;87:467–71
Ein kleiner Tipp am Rande: Die Qualität der äußeren Narbe kann u.U. Rückschlüsse auf die Art und das Ausmaß von Verwachsungen im Abdomen liefern.